
M. Darwin,修补匠
有一种小商店曾经遍布巴黎,至少在真正有人居住的街区 (quartiers),它们的牌子上写着“修补匠”(Bricoleur)。商店里摆满了商品 — 随机摆放,布满灰尘,但有用 —至少理论上对某些人是有用的。
伟大的 François Jacob — 分子生物学创始人之一,也是第二次世界大战法国抵抗运动的英雄,长期居住在巴黎 — 在谈到 bricolage(他翻译为修补 (tinkering))时说:“修补匠会随手拿起一个废旧的东西进行改造,使之获得意想不到的功能。他会将一个旧汽车轮子做成一个风扇;将一张破桌子做成一把遮阳伞”。这不仅仅是 Jacob 感伤的回忆,更是对进化及其偶然性的基本表述。“这一过程与进化过程中把一条腿变成一个翅膀,或者把下巴的一部分变成一只耳朵没有太大不同。”
按照拟人化的说法,进化过程并不是经过精心设计的,而是通过随机突变来“修补”生物体基因组中已存在的任何基因。“与精心设计相比,进化不会从零开始创新。自然选择与人类行为的任何方面都没有相似之处。然而,如果有人想做个比较,就不得不说,这个过程不像精心设计的,而更像修补,在法语中称为 bricolage。把一块食道变成肺,听起来很像用奶奶的一块窗帘做裙子。”1
基因变异偶然事件的累积,其中极小的一小部分驱动着看似有目的的轨迹,实际就像是用奶奶的窗帘做裙子。
而且,就像修补术一样,当事情出错时,结果可能会变得非常糟糕。
癌症 — 基因?
我们对基因和癌症关系认识的发展与我们对遗传学和分子生物学本身认识的发展是同步的。科学家在 19 世纪末证实了中期染色体与遗传之间存在联系,对快速分裂的癌细胞聚缩的中期染色体进行检查,发现了异常的染色体结构。此后不久,Theodor Boveri2 提出获得的染色体异常可导致癌症,引发细胞分裂失控。其发生机制当时还未得到确定。
癌症 — 感染?
Novinsky 证明,癌症有时可以从一只狗传染给另一只狗,这一发现早于染色体相关研究。传染性癌症看起来像是一种传染病。在 1911 年,Peyton Rous3 证明了“少量的无细胞滤液”会将肉瘤从一只鸡传染给另一只鸡。无细胞的传染性液体,即传染性活液 (contagium vivum fluidum),在 1898 年首次被命名为病毒4,但是直到 1935 年才通过电子显微镜证明病毒实际上是离散的微粒。那么,癌症真的是一种传染病吗?
就在 Boveri 和 Rous 发表他们相互矛盾的理论时,Phoebus Levene 提出了生物学历史上最具误导性的理论之一:错误的四核苷酸假说。该假说“显而易见”地认为,这么简单的核酸分子不可能是遗传信息的载体。核酸被误认为是染色体中的某种结构元素,而某种(些)未知的蛋白质则被认为是基因的物理基础5。那么所有这些又与癌症有什么关系呢?
打好正确的基础
直到 20 世纪 40 年代末,分子遗传学的面貌才开始变得更加明朗,对我们来说也更加熟悉。Avery、Macleod 和 McCarty,以及 Hershey 和 Chase 分别明确地证明了核酸是遗传信息的载体。然后,Erwin Chargaff 对不同生物体 DNA 的碱基组成进行了定量分析,总结出了著名的“Chargaff 法则”,这不仅推翻了四核苷酸假说,而且成为了 Watson 和 Crick 构建双螺旋模型的基础。因此,应该是 DNA 转录为 RNA,RNA 翻译成蛋白质。然后,随着逆转录酶的发现,我们知道 RNA 可逆转录为 DNA,DNA 转录为 RNA,RNA 翻译成蛋白质。那么这些发现与癌症有什么关系呢?
劳斯肉瘤病毒 (RSV) 和大多数病毒一样,相对比较简单,只有 4 个基因。Vogt5 实验室的突变研究表明,RSV 的 4 个基因中的 1 个,称之为 src 或 sarc,导致病毒具有致癌特性。如果 src 发生突变,病毒仍然具有感染性,但不再致癌。因此,src 基因通过掺入细胞基因组“导致”癌症。他们把 src 称为致癌基因 (oncogene) — 一种导致癌症的基因。
但是,Peyton Rous 不相信癌症有遗传原因。在发现 RSV 50 多年后,他终于在 1966 年获得了诺贝尔奖(突变分析重新点燃了人们对 RSV 的兴趣),但他不能接受癌症具有遗传基础。在接受诺贝尔奖的演讲中,他直截了当地下结论:
“最能为人接受的一种解释是,致癌物质 (oncogen)* 导致身体细胞的基因发生改变,即所谓的体细胞突变。但是,把许多事实结合起来,就可以果断地排除这种假设。”6
* 不要和致癌基因 (oncogene) 混淆。Rous 坚持使用 oncogen(比 oncogene 少一个 e)这个词来描述致癌的化学物质,而不是普遍使用的术语 carcinogen
“答案”浮出水面
然后一个重大的发现消除了之前的所有困扰。加州大学旧金山分校 (UCSF) 的 J. Michael Bishop 和 Hal Varmus 的研究团队表明,在鸟类的基因组中存在 src 基因的类似物7,而且随着研究范围的扩大,其似乎存在于任何动物的基因组中。内源性致癌基因,即原癌基因,就像细胞中一个滴答作响的定时炸弹。通过诱变剂、紫外线照射,或者仅仅是复制过程中的一个错误,使其发生突变,就会导致癌症。最后,出现了一个分子水平的解释。自 Varmus 和 Bishop 之后,已经发现了大约 40 个其他的原癌基因。就像细胞核中潜藏着 40 个滴答作响的定时炸弹。
遗传学家最喜欢的数字
20 世纪 60 年代末,Henry Harris 等人进行的细胞融合实验表明,正常细胞与癌细胞的融合抑制了癌细胞的致癌性。然后,在一项具有里程碑意义的视网膜母细胞瘤研究中,Alfred Knudson 研究了有视网膜母细胞瘤家族史儿童与无视网膜母细胞瘤家族史儿童的视网膜母细胞瘤发病率,提出了“二次打击”假说,即视网膜母细胞瘤的发生需要经历两次突变事件。对于一个杂合子儿童,他有一个正常的基因副本和一个已突变的副本,只需要一次突变就会导致视网膜母细胞瘤。相比之下,一个具有两个正常基因的纯合子需要发生两次突变事件,考虑到恒定的体细胞自发突变率,这需要更长的时间。Knudson 于 1971 年发表的开创性论文8 中的图 1 一定是生物学历史上最重要、最美丽的曲线之一,清楚地显示了预测行为。一个基因的两个副本必须被某种突变“敲除”(按我们今天的说法),才能导致癌症,正如孟德尔遗传学预期的隐性(不表达功能)基因特性一样。
基因双生子
致癌基因和抑癌基因的存在几乎是镜像式的。原癌基因和抑癌基因蛋白都参与了正常细胞生长的调控。原癌基因的突变会敲入 (knock-in) 功能,使细胞生长失控,而抑癌基因的突变则会敲除 (knock-out) 其调控细胞生长的能力。两者都会导致相同的癌症结果。
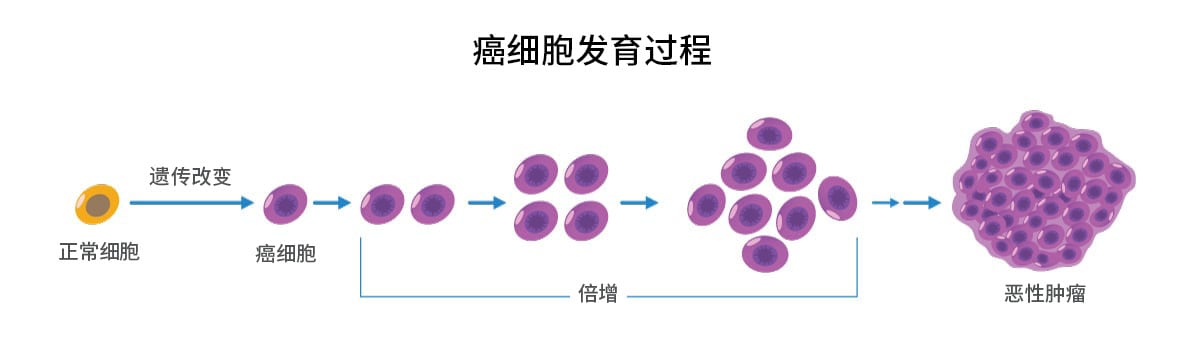
癌症:修补术失败
在发生可预测的事件时,系统自身可能发生灾难性故障;哪个工程师会设计出这样的系统?我们现在知道原癌基因和抑癌基因编码参与细胞调控的激酶、转录因子或其他重要蛋白质。它们的突变往往导致精细调节的细胞控制网络失调。 我们可以越来越多地描绘出这些突变蛋白引起的细胞失调,如蛋白质磷酸化的变化改变了信号级联,代谢和细胞内转运的改变导致代谢物浓度的变化等。最终将致癌基因和抑癌基因突变(尤其是驱动突变)与细胞生理和细胞外肿瘤微环境的变化联系起来,使我们能够全面地了解肿瘤细胞生理学。
当然,转化和肿瘤发生需要多个突变事件,所以仅仅一个突变不太可能转化细胞。事实上,肿瘤突变负荷 (TMB) — 一个给定的肿瘤细胞有多少体细胞突变 — 现在成为了预测治疗反应的一个重要的生物标志物。

最近,一些研究人员试图通过靶向突变致癌基因或抑癌基因所产生的 HLA 多肽(他们称之为新抗原)来靶向癌细胞。约翰霍普金斯大学最近在Science9 和 Science Immunology10 杂志上发表的两篇文章表明,T 细胞结合双特异性抗体能够结合突变的致癌基因产生的 HLA 呈递肽或抑癌蛋白,并在某些情况下在体内表现出活性。
显然,当涉及到癌症时,修补术是两者(致癌基因和抑癌基因)之间的游戏。