大约 100 年前,德国科学家 Otto Warburg 发现了一种现象,后来以他的名字对这种效应进行了命名。简单地说,Warburg 描述了对肿瘤细胞能量产生方式的观察结果,并揭示了一个基本事实,这一事实现在仍然是我们主流癌症认识和治疗方式的基础。
在一篇具有里程碑意义的论文[1] 中,Warburg 证明了癌细胞并非简单的分裂速度更快的正常细胞;即使在基本的细胞内生理学上,癌细胞与产生它们的正常细胞也有着本质的不同。
现在称之为 Warburg 效应,这一概念以及为其提供支撑的代谢观察结果持续推动着癌症研究的发展。事实上,2006 年 Seahorse Bioscience(现已加入安捷伦)的成立从某种意义上来讲缘于研究人员未得到满足的需求,即能够以前所未有的准确度、精密度和通量检测 Warburg 观察到的同类代谢过程。
Warburg 与 Warburg 效应
Warburg 于 1926 年开始就一个非常简单的假设进行测试:由于肿瘤细胞比正常细胞的生长速度更快,癌细胞的耗氧率应该高于正常细胞。早在 1906 年,他就证明了海胆卵受精后吸氧量会增加。然而,大鼠肝脏组织切片的结果显示耗氧量并没有增加,但乳酸产生量(通过降低的 pH 值和增加的 CO2 产生量间接测得)要比正常细胞(正常细胞仅在厌氧条件下产生乳酸)高出 70 倍之多。
这导致了一个难题:尽管癌细胞可以呼吸,但癌细胞在有氧状态下会使用正常细胞仅在无氧条件下才会使用的糖酵解途径。有氧条件下的糖酵解 — 有氧糖酵解被称为 Warburg 效应。
获得认可,然后被遗忘
当然,1926 年癌症遗传学仍处于非常初级的状态,而分子生物学,即使是首个证明 DNA 是遗传物质的实验,也在几十年后才发生。尽管癌细胞的有氧糖酵解被接受(事实上,诺贝尔委员会曾考虑将 1927 年的诺贝尔医学奖授予 Warburg,以表彰他在癌症领域所做的工作),但尚不清楚是什么原因导致了这一现象,是由自身导致,还是仅仅是一个有趣的观察结果。
Warburg 认为癌症最终由破坏细胞呼吸器官(我们现在知道的是线粒体)的化学物质引发,这些化学物质破坏了细胞进行氧化磷酸化的能力。事实上,Warburg 对此深信不疑,以至于他在余生中拒绝吃任何经过农药或其他化学物质处理的食物。他购买土地来种植自己的所有农产品(这一定是最早的现代有机花园之一),从未经化学处理的奶牛群挤牛奶,只吃磨坊主承诺仅用无农药谷物磨出的面粉制成的面包。
Warburg 将这些信念坚持到他生命的尽头,并于 1967 年写道[2]:
“癌症的主要原因是正常体细胞的氧气呼吸被糖的发酵所取代。所有正常体细胞通过呼吸氧气来满足其能量需求,而癌细胞则主要通过发酵……不存在癌细胞时呼吸是完整的,因此毫无疑问,如果体细胞的呼吸功能保持完整,则可以预防癌症。”
那时,大多数研究人员已经开始认为 Warburg 效应有点奇怪,很难适应“现代”癌症研究的背景。Warburg 的态度可能是导致他的想法被忽视的原因。
Warburg 与 Warburg 效应,得到重新审视
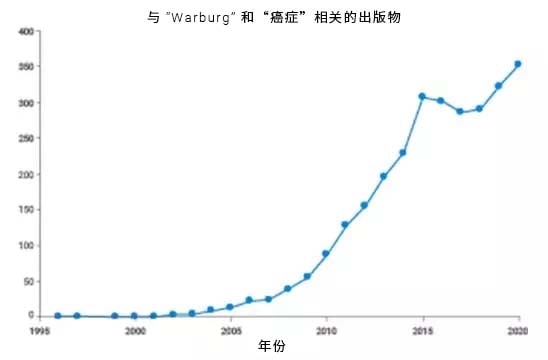
几位编者绘制了与 Warburg 效应相关的出版物数量随时间变化的曲线。下图显示了 2006 年左右的一个拐点,从 2005 年到 2015 年,从每年几篇出版物增长到数百篇[3]。2016 年,《纽约时报》杂志甚至有一篇关于 Otto Warburg 以及人们对 Warburg 效应的重新关注的专题报道[4]。为什么会这样?
首先,有点矛盾的是,Warburg 提出的因果论被证明是错误的。2006 年,Phil Leder 及其同事的研究表明,抑制癌细胞的有氧糖酵解(通过敲除乳酸脱氢酶)会以氧依赖的方式导致耗氧量和线粒体氧化磷酸化的代偿性增加[5]。敲除 LDH 还会抑制癌细胞的增殖能力,因此肿瘤细胞保留了正常“呼吸”的能力,但优先利用有氧糖酵解,快速生成较少的 ATP,使它们能够更快地生长和分裂。它们优先利用有氧糖酵解,从而实现“欺骗”。在随附的评论文章中,Bui 和 Thompson 在最后宣称,“现在,癌症生物学家需要修订生物化学教材了。似乎还有几章需要编写[6]。”
大约在同一时间,人们开始认识到,不仅是葡萄糖代谢,而且癌细胞的整个代谢程序都紊乱了。为了保持极快的细胞生长和分裂速度,癌细胞需要以比正常细胞快得多的速度合成蛋白质、核酸和大量的其他细胞成分。
然而,Warburg 效应(有氧糖酵解与氧化磷酸化)只与分解代谢相关,即分解糖类产生能量。虽然能量代谢至关重要,但合成代谢(即合成大分子和细胞结构成分的代谢途径)也同样被破坏;正常细胞将无法满足需求。事实上,研究表明某些癌细胞非常需要氨基酸,以至于它们使用变形虫遗留下来的一种叫做胞饮作用(来自希腊语,意思是“喝”)的内吞机制,从细胞外环境中清除完整的蛋白质,通过溶酶体降解将其分解为组成氨基酸[7]。这些都是为了给过热的合成代谢炉提供原料,使细胞能够更快地生长和分裂。
新的遗传学和代谢组学经验
当致癌基因和肿瘤抑制基因被发现时,我们首次能够直接证明致癌基因的存在或肿瘤抑制基因两个拷贝的突变与恶性转化之间的因果关系。细胞生长因子的发现意味着开始可以绘制导致显示“癌症特征”的细胞的因果链。因此,癌症研究变成了分子生物学的研究。
癌症遗传学和新陈代谢之间的联系为观察 Warburg 提供了新的线索。致癌基因的激活或肿瘤抑制基因的失活会重编程癌细胞的新陈代谢[8],增加葡萄糖摄取为“饥饿”癌细胞提供保持生长所需的燃料,并强化产生所需分子的合成代谢通路。例如,myc 致癌基因的激活会破坏生长因子介导的 myc 蛋白控制,而 Myc 蛋白则作为许多参与营养物质输送和合成代谢通路的基因的转录因子[9]。
当然,代谢物不会简单地在细胞中被动地等待某个通路的作用,而是本身可以作为基因表达和细胞信号传导的调节剂(例如 40 年前,乳糖和环腺苷酸被证明可以调节大肠杆菌中 lac 操纵子基因的表达)。最后,我们开始可以画出一连串因果关系,从基因改变到蛋白质/酶浓度和活性的变化,再到小分子代谢物浓度的变化。
代谢组学(小分子代谢物的鉴定和定量)是一种非常适合使用气相色谱和液相色谱作为前期分离的质谱技术的应用。安捷伦开发了用于代谢物分析的独特质谱硬件、软件和常用备件组合,帮助研究人员更深入地研究代谢组及其在癌症中的作用。
Otto,胜利者的微笑
那么,为什么近一个世纪后,在知道 Warburg 错得离谱的情况下,科学家们仍在引用和讨论 Warburg 效应?我们仍然从恶性转化的角度来谈论,因为细胞确实转化成了新的东西。如果 Warburg 在因果关系上是错误的,部分原因是他遥遥领先于他的时代。
当科学家拥有解答他们想问的问题的工具时,科学就会进步。如果意识不到 Warburg 在近一个世纪前做出的贡献,现在仍然无法研究癌细胞生物学。有效抗击癌症需要详细了解其背后的细胞病理学,这正是安捷伦 Seahorse 仪器和质谱平台所能提供的信息,它们通过将细胞能量代谢、基因组学和代谢组学的研究从深奥变得常规,持续推进癌症研究并为生物科学团队提供支持。
仅限科研使用。不用于临床诊断用途。
相关文章